01 . Les caractéristiques des batteries
Historique et théorie
Préambule :
Si le plomb a disparu dans le transport et la distribution de notre eau potable, il reste bien présent, pour des décennies, dans nos batteries d'accumulateurs au plomb .
Pour comprendre comment fonctionne votre batterie, il est important de savoir comment il a été possible de stocker de l'énergie électrique dans une boîte en plastique ! … alors que vous savez comment stocker (ou graver) des données sur un disque ou un support informatique .
Bref rappel historique :
Le premier accumulateur au plomb fut mis au point par le scientifique belge Monsieur Gaston Planté au XIXième siècle, en 1859 exactement : le 26 mars 1860, il présentera à l'Académie des Sciences, sa célèbre communication sur une "nouvelle pile secondaire d'une grande puissance" . (voir l'article sur Les découvertes )
On parlait déjà de " pile " car celle-ci fut découverte vers la fin du XVIIIième et c'est en 1800 que Monsieur Alessandro Volta en fit la première démonstration en réalisant un empilement d'éléments composés successivement d'une lame de zinc, d'une lame de feutre imbibée d'eau vinaigrée et d'une lame de cuivre . Il créa ainsi le premier dispositif de production électrochimique d'énergie électrique : la dénomination " pile " qui lui est attribuée trouve son origine dans la structure de ce " générateur " : un empilement de générateurs élémentaires .
Ensuite l'unité de tension (différence de potentiel) aux bornes de ces générateurs sera le Volt, en hommage à Alessandro Volta, à l'origine de la découverte de la pile voltaïque .
La grande découverte fut donc cette fameuse pile rechargeable ! … la différence entre une pile et un élément d'accumulateur est que la pile, une fois son énergie restituée, reste inutilisable alors que l'accumulateur aura la possibilité de régénérer ses plaques internes, de stocker de l'énergie et de fournir à nouveau un courant d'où la formulation de " pile secondaire d'une grande puissance " !
Le terme « accumulateur », employé pour un élément rechargeable, le distinguant ainsi de la pile (élément non rechargeable) est un générateur réversible : il peut stocker (accumuler) de l'énergie en convertissant l'énergie électrique en forme chimique, puis la restituer à tout moment sur demande en retransformant cette matière chimique en énergie électrique .
Ce processus serait quasiment " sans fin " s'il n'y avait pas la fatigue des éléments internes et leur détérioration .
Ce qui va suivre a été volontairement simplifié, pas de formules chimiques, pour que vous compreniez bien ce qui se passe à l'intérieur de votre bac quand vous branchez votre batterie 12 Volts sur votre installation ou/et quand vous rechargez celle-ci .
Cela vous aidera à mieux appréhender par la suite les divers symptômes rencontrés lors de l'existence de votre batterie d'accumulateurs tels que :
- élévation anormale de la température,
- déformation du bac,
- sulfatage des bornes,
- batterie ne tenant plus la charge,
- etc, etc ...
Fonctionnement d'un élément d'accumulateur :
Un accumulateur au plomb élémentaire est constitué d'une plaque de plomb spongieux (Pb) et d'une plaque de bioxyde de plomb (PbO2) .
Quand ces plaques sont plongées dans une solution d'acide sulfurique (H2SO4), cet accumulateur est soumis à deux réactions chimiques différentes qui sont :
- la décharge lorsqu'un récepteur est raccordé sur ses bornes,
- la charge lorsqu'une tension externe est présente à ses bornes .
Explications :
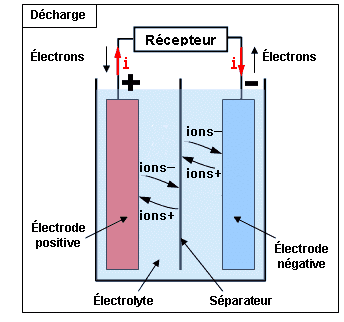
a) Phénomène de décharge :
Quand deux électrodes, les deux plaques de plomb, sont plongées dans l'électrolyte (mélange d'eau distillée 65% et acide sulfurique 35%) et que l'on relie un récepteur aux bornes de l'accumulateur, entre le positif et le négatif, les réactions chimiques créent la circulation d'un courant électrique .
Ce courant électrique s'établit entre la plaque de bioxyde de plomb, appelée anode, et la plaque de plomb appelée cathode . ????????????????
Pendant cet état de décharge, le bioxyde de plomb de la plaque positive (anode) se transforme ????????????graduellement en sulfate de plomb (PbSO4) et le plomb spongieux de la plaque négative (cathode) se transforme ???????????également en sulfate de plomb .
Lorsque les plaques deviennent identiques, la même quantité de sulfate de plomb de part et d'autre, la différence de potentiel entre ces deux plaques s'annule et la circulation du courant s'interrompt : l'élément d'accumulateur est en situation de décharge profonde !
La quantité d'électricité circulant pendant une période de décharge déterminera la capacité de la batterie .(voir chapitre Les capacités)
En résumé, au cours de la décharge :
Anode (+) : - le bioxyde de plomb diminue, - le sulfate de plomb augmente,
Cathode (-) : - le plomb diminue, - le sulfate de plomb augmente,
Electrolyte : - le % d'eau augmente, = 85% - le % d'acide diminue, = 15%
b) Phénomène de charge :
Afin de recharger l'accumulateur, il faut relier les bornes de l'accumulateur à celles d'une source de tension continue (chargeur de batterie) : la borne de la source de tension à la borne de l'accumulateur (anode), celui-ci devenant récepteur vis-à-vis de la source de tension .
Le sens de circulation du courant électrique pendant la charge est l'inverse du sens de circulation de la situation de décharge .
Le sulfate de plomb présent sur les deux plaques est dissous par le passage du courant et les plaques reprennent leur état initial .
Le phénomène chimique serait "sans fin", s'il n'y avait pas la fatigue des éléments internes et leur détérioration .
En résumé, au cours de la charge :
Anode ( ) : - le bioxyde de plomb augmente, - le sulfate de plomb diminue,
Cathode (-) : - le plomb augmente, - le sulfate de plomb diminue,
Electrolyte : - le % d'eau diminue, - le % d'acide augmente .
Conclusions :
1 . Pendant la décharge de l'élément accumulateur (qui correspond à l'utilisation de votre batterie : éclairage, réfrigérateur, etc...) la réaction chimique forme des cristaux de sulfate de plomb insolubles qui cristallisent dans les pores des plaques de l'accumulateur .
Au niveau de l'électrolyte, la concentration d'acide diminue fortement : si vous mesurez la densité de l'électrolyte à l'aide d'un pèse-acide avant (sur une batterie chargée) et après (sur une batterie en décharge ou totalement déchargée), vous trouverez des valeurs très différentes .
2 . Pendant la charge de l'élément accumulateur (mise en charge par votre panneau solaire ou votre chargeur secteur) la réaction chimique se fait essentiellement autour de la reconstitution d'acide sulfurique autour des électrodes .
Conséquences :
Lors d'une charge après une décharge relativement profonde, une importante quantité d'acide sera reconstituée au niveau des plaques . Cet acide concentré se mettra à suinter vers le fond de votre batterie . Généralement, vers 90% de la phase de recharge, la partie basse des éléments contient de l'électrolyte concentré et la partie haute de la cuve, de l'électrolyte dilué : on dit que l'électrolyte est stratifié .
Arrêter la charge à ce stade aurait des conséquences désastreuses, à savoir un fonctionnement hétérogène des électrodes, menant à une fatigue rapide de leur partie inférieure, d'où l'importance de s'équiper d'un excellent régulateur de charge au niveau de votre panneau solaire et d'un chargeur de batterie de grande qualité voire de type IUoU .
Les 10 derniers % de recharge sont les plus importants, ceux sont eux qui vont conditionner la durée de vie de votre batterie .
La phase finale de la charge est dite « de surcharge » .
C'est la phase pendant laquelle le courant se partage en un courant de charge proprement dit et en un courant d'électrolyse .
L'électrolyse c'est quoi ? … ici on parle de l'électrolyse du liquide se trouvant dans la partie haute de la cuve : l'électrolyse de l'eau est un procédé qui décompose l'eau en créant de l'oxygène et de l'hydrogène lorsqu'elle est traversée par un courant électrique .
(voir chapitre Processus d'autodécharge )
Ce courant d'électrolyse produira de l'oxygène à l'électrode positive et de l'hydrogène à l'électrode négative . L'intérêt de ce processus étant de se rapprocher le plus possible de l'état de charge complète de l'accumulateur mais aussi, grâce au dégagement gazeux dans la cuve, de réhomogénéiser la concentration de l'électrolyte puisque l'électrolyte concentré se trouve en partie basse de la cuve .
Cette réhomogénéisation de l'électrolyte est la principale fonction à assurer en fin de charge . Elle est nécessaire à chaque charge, sous peine d'entraîner un fonctionnement hétérogène des électrodes menant à une réduction importante de leur durée de vie .
Si vous avez bien compris le processus de fonctionnement de cet élément d'accumulateur, vous saurez déceler par la suite les anomalies pouvant survenir sur votre batterie .
(voir chapitre suivant Le fonctionnement des batteries )
Rappel des découvertes
Historique de la batterie d'accumulateurs
Dû à son applicabilité universelle, l’énergie électriques joue un rôle prépondérant dans la technologie d’aujourd’hui.
" L’inconvénient ": De toute évidence nous avons besoin de l'électricité. Il ne peut pas être entreposé ou ne peut être créé par de simples appareils; il doit être obtenu directement d'une centrale électrique. La quantité d'énergie électrique qui peut être emmagasinée directement, i.e. dans les condensateurs, est si petite qu'elle peut seulement être utilisée dans les applications où une très faible demande est exigée pour compenser des interruptions d'alimentation électrique. Par conséquent, pour que l'énergie électrique soit conservée, elle doit être convertie sous une autre forme d'énergie.
Les batteries, aussi appelée " accumulateurs ", sont des réservoirs d'énergie électrochimiques qui utilisent les propriétés chimiques pour le stockage. Dans cet historique, nous verrons une vue d'ensemble des systèmes du stockage. Nous commencerons avec l'historique de l'emmagasinage d'énergie électrochimique et la naissance de la batterie d'accumulateurs acide/plomb.
Historique sur l'emmagasinage d'énergie électrochimique
Les premières recherches scientifiques coïncident au tout début du développement des systèmes du stockage d'énergie électrochimiques . Des noms tels que Luigi Galvani (1737 à 1798) et Alessandra Cont di Volta (1745 à 1827) sont associés à ces découvertes et existent aujourd'hui sous des termes tel que " galvanisation " et " voltage ".
Dans ses expériences, Luigi Galvani a remarqué que la patte d'une grenouille morte se contractait quand elle entrait en contact avec deux métaux différents . Il conclue qu'il y a un rapprochement entre l'électricité et l'activité musculaire . Volta orienta ses recherches sur les effets produits quand différents métaux entrent en contact avec des solutions salines . Il empila des plaquettes de cuivre et de zinc en alternance et inséra un morceau de carton trempé d'une solution saline entre chaque plaquette . Cette " batterie voltaïque " ou " organe électrique artificiel " comme s'amusa à décrire Volta, fourni de l'électricité quand les plaquettes furent reliées à des fils conducteurs . Des recherches supplémentaires, confirmèrent rapidement la corrélation entre les réactions chimiques et l'énergie électrique.
Dans la foulée des recherches sur le plomb/acide sulfurique/bioxyde de plomb un système a été découvert : La batterie d'accumulateurs acide/plomb . Ce système a été utilisé pour emmagasiner l'électricité pour les télégraphes, par Gaston Planté (1834 à 1889) en 1859 . Ils utilisèrent des plaquettes de plomb en guise d'électrodes . Ils ont obtenu une certaine capacité aux fils des charges/décharges répétées . Ces batteries n'étaient cependant pas adaptées à une production industrielle .
À la fin du 19e siècle, la recherche pour développer des accumulateurs électrochimiques a évolué rapidement . La dynamo et l'ampoule ont été inventées et, dû aux développements industriels, le besoin d'emmagasiner l'énergie électrique augmenta . La production industrielle de batteries d'accumulateurs acide/plomb débuta autour de1880, quand Émile Alphonse Faure demanda un brevet pour la fabrication de plaquettes enduites d'une pâte pour les batteries d'accumulateurs acide/plomb .
Les premiers balbutiements de la batterie d'accumulateurs acide/plomb
Autour de 1880, Émile Alphonse Faure a développé un processus pour couvrir les deux côtés d'une plaquette de plomb d'une pâte composée de poudre de plomb et d'acide sulfurique . Cela signifiait que ce " soi-disant " dispositif pourrait contenir, particulièrement, une grosse capacité dès la première charge . Ce fut une percée considérable qui mena la batterie acide/plomb directement à sa fabrication industrielle . Plusieurs compagnies spécialisées sont apparues, y compris S. A. La Force et, la Lumière, pour laquelle William Thomson, devenu plus tard Lord Kelvin of Largs, a travaillé comme ingénieur associé . L'échelle de température absolue fut nommée en son nom .
Au début, les plans furent conçus pour construire de gros accumulateurs d'énergie électrique pour les fournisseurs d'électricité . À la demande de la ville de Buffalo, W. Thompson a établi un plan pour alimenter la ville avec de l'électricité provenant des chutes Niagara . Il généra 80,000 volts et alimenta Buffalo avec une batterie de 40,000 cellules . Branchées par groupes de 50 cellules, elles alimentèrent les maisons d'une tension de 100 volts .
Cependant, les cellules de Faure dans lesquelles les électrodes positives et négatives étaient enroulées en spirale démontrèrent une faible durabilité aux cycles de charge/décharge . Par conséquent, ce fut l'échec des premières tentatives de fabrication en industrie .
En 1881, M. Sellon a demandé un brevet pour un procédé qui consiste à appliquer la pâte sur une plaquette perforée plutôt qu'une plaquette lisse . Il améliora considérablement plus l'adhérence que Faure . Sellon utilisa de l'antimoine comme matière . Parallèlement, Volkmar développa une procédure similaire qui consistait à utiliser une grille de plomb . Alors la plaquette formée d'une grille était inventée et bientôt testée et appliquée à une gamme de variantes . Aussi en 1881 C. Brush fait une demande de brevet pour une électrode de plomb à grande surface mais ondulée . C'était le signe avant-coureur de la plaquette à grande surface utilisée aujourd'hui .
Un autre type de plaquette qui joue encore un rôle important aujourd'hui qui était aussi disponible : la plaquette tubulaire ou plaquette blindée . Sous cette forme, une tige de plomb traverse le centre d'un tube (normalement) de 8 mm de diamètre et sert à dévier le courant . L'adhérence de la matière active est obtenu en utilisant un revêtement externe . Des composants différents sont donc utilisés pour dériver le courant et stabiliser la structure mécanique . Résultat de cette configuration : plusieurs cycles de charge/décharge et un plus haut niveau d'utilisation effective de la matière active . Au début, les tubes étaient emboîtés et composés de caoutchouc dur . Après la deuxième guerre mondiale, la fibre de verre tressées, matière tissée de verre et de fibres artificielles, la matière purement artificielle ou matière non-tissée (polyester), entrèrent dans la composition des tubes .
L'élément primaire :
En 1786, le biologiste Luigi Galvani a disséqué une grenouille. A chaque fois que le scalpel en acier de Galvani touchait un crochet en cuivre, qui tenait en place la cuisse de la grenouille, celle-ci se contractait. Galvani pensa que cette énergie provenait de l'animal et l'a donc appelée "électricité animale".
L'ami et associé de Galvani, Alessandro Volta, n'était pas d'accord avec cette idée. Il était convaincu que l'électricité avait été générée par les deux différents métaux dans un milieu humide. Des expériences ont ensuite confirmé cette idée et en 1797, Volta conçut la vraie première batterie : la pile voltaïque. La pile était composée de 49 paires de disques de cuivre et de zinc, disposés alternativement, séparés par un tissu trempé dans de l'eau salée. Et lorsque les deux extrémités étaient connectées à un conducteur, le courant passait.
Dans une pile voltaïque, l'électricité est générée par une réaction chimique et lorsqu'elle est épuisée, la pile ne peut pas être rechargée. Cela s'appelle un élément primaire.
L'élément secondaire :
Dans une pile voltaïque, l'électricité est générée par une réaction chimique et lorsqu'elle est épuisée, la pile ne peut pas être rechargée. Cela s'appelle un élément primaire.En 1803, le physicien allemand Johann Wilhelm Ritter a conçu une pile voltaïque à l'envers. La pile de Ritter se composait de disques en cuivre uniquement, séparés de couches de substance à base de carton trempé dans une solution saline. La colonne de Ritter pouvait accumuler de l'énergie électrique, mais en aucun cas la produire. Cela s'appelle un élément secondaire, batterie de stockage ou accumulateur. L'électricité nécessaire à la charge de la pile de Ritter pouvait seulement être obtenue par une source de courant primaire, telle qu'une pile voltaïque. Cela rendait la découverte de Ritter intéressante certes, mais peu pratique d'utilisation.
1854 a marqué une étape importante dans le développement de l'électricité. Le médecin et scientifique allemand Joseph Sinsteden plaça deux plaques en plomb dans un bac contenant de l'acide sulfurique dilué. Cet acide sulfurique réagit avec la surface des plaques et forma une couche de sulfate de plomb. Sinsteden connecta les plaques à une source de courant primaire et constata qu'une couche d'oxyde de plomb se formait sur une plaque, tandis que du plomb spongieux se formait sur l'autre. Après cette charge, la batterie pouvait à nouveau être déchargée : il y avait un courant non inférieur à 2 V : ce qui représentait bien plus que ce que les prédécesseurs de Sinsteden, Volta et Ritter, avaient jamais pu réaliser. Pendant la décharge du sulfate de plomb se formait sur les deux plaques, exactement comme lors de la première fois. Ainsi, le processus pouvait redémarrer. La batterie plomb/acide venait de voir le jour !
La plaque Planté
En se basant sur les travaux de Sinsteden, le scientifique belge Planté développa en 1861 la première batterie secondaire à usage pratique, dans laquelle les plaques en plomb étaient roulées en bobines et séparées par des bandes de feutre.
Dans l'élément de Planté, nous reconnaissons tout l'équipement de la batterie plomb/acide existant de nos jours : de l'acide sulfurique dilué dans lequel sont plongées deux plaques en plomb, couvertes de sulfate de plomb. La feuille de plomb sert uniquement de conducteur, car le vrai processus a lieu sur le sulfate de plomb et c'est pour cela qu'il est appelé "masse active". La préparation de la plaque en plomb, en permettant la création du sulfate de plomb, est appelée "formation".
La formation des plaque de Planté fut une tâche longue et difficile. Avant que ne ce soit formé assez de sulfate de plomb sur la plaque ne plomb, il fallait qu'elle se charge et se décharge de manière réitérée. Cela pouvait prendre des semaines, et parfois même des mois, avant d'obtenir la capacité souhaitée.
En 1881, la plaque de Planté fut améliorée par Charles Francis Brush. Il appliqua de l'oxyde de plomb sur des plaques, qui avaient été incisées, fendues ou perforées, en introduisant l'oxyde en fine poudre dans les cavités. Cette méthode représente encore la base de la plaque de Planté actuelle.
L'autodécharge des batteries au plomb
Les batteries au plomb sont soumises à de phénomènes d'auto-décharge . L’origine de l’autodécharge provient des réactions secondaires se produisant au niveau des électrodes . Ces réactions secondaires sont nombreuses et plus ou moins prépondérantes les unes par rapport aux autres . En outre, ces réactions secondaires ne sont pas encore toutes identifiées par la communauté scientifique . Nous présentons ci-après une d’entre elles .
Les oxydants et les réducteurs :
Par réaction électrochimique, le courant électrique est produit par la circulation d'électrons entre 2 plaques ou électrodes :
-
une électrode positive ou plaque positive composée d'un corps oxydant, capable d'attirer des électrons,
-
une électrode négative ou plaque négative composée d'un corps réducteur, capable de céder des électrons.
Une batterie ou une pile se caractérise donc tout d'abord par un couple «oxydant-réducteur», (par exemple Plomb/Oxyde de plomb, Nickel/Cadmium...) échangeant des électrons. L'association de deux plaques constitue l'entité primaire d'une batterie.
Les deux plaques baignent dans une solution électrolytique (ou électrolyte), liquide ou sous forme de gel. C'est la réaction entre la solution et les électrodes qui est à l'origine du déplacement des électrons et des ions dans la solution. Ainsi, l'électrolyte a pour fonction d'assurer la conduction ionique et, plus généralement, de participer à la réaction chimique.
Un isolant poreux (ou séparateur) permet de séparer les deux plaques tout en autorisant le passage des ions.
a) les oxydants
b) les réducteurs
Au niveau de chaque électrode, des réactions d’oxydoréductions peuvent se produire naturellement . En effet, l’anode constituée de plomb (Pb) peut réagir avec les ions H3O+ présents dans l’électrolyte . Egalement, la cathode composée d’oxyde de plomb (Pb02) peut réagir avec l’eau H20 présente dans l’électrolyte .
Chacune de ces réactions se produisent au niveau des électrodes entre des oxydants et des réducteurs sans transport de charge à travers l’électrolyte. Les matériaux actifs des électrodes y participent.
A la cathode : L’eau de l’électrolyte est oxydée dégageant du dioxygène gazeux (O2) et 2 électrons. Ces deux électrons sont directement exploités par l’oxyde de plomb (PbO2) de la cathode. Le plomb (Pb) est alors réduit en ions Pb2+.
A l’anode : Le plomb (Pb) est oxydé en ions Pb2+ libérant 2 électrons. Ces deux électrons sont directement consommés par les ions H3O+. Les ions H3O+ sont alors réduits dégageant du dihydrogène gazeux (H2).
De ce fait, l'électrolyse de l'eau induit une baisse de performance pendant la décharge car une partie des électrons produits par la réaction principale sert à enclencher l’électrolyse de l’eau et non à alimenter les charges électriques.
Egalement, lorsque la batterie est déconnecté, la tension induite par les électrodes est suffisante pour forcer l'électrolyse de l'eau et provoquer ainsi l'auto-décharge.
L'auto-décharge d'une batterie présente donc deux conséquences préjudiciables :
Lorsque la batterie est déconnectée (circuit ouvert), elle s'auto-décharge.
Ainsi, une batterie chargée qui ne serait pas sollicité se retrouve complètement déchargée au bout de plusieurs mois.
Nous donnons ci-dessous les temps d'auto-décharge typique d'une batterie au repos (en circuit ouvert) en fonction de la température ambiante :
 Temps d'auto-décharge des batteries au plomb en fonction de la température ambiante. Les batteries au plomb s'auto-décharge d'autant plus vite que la température ambiante est élevée. Le taux d'auto-décharge des batteries actuelles, en terme de perte de capacité, est réduit en moyenne entre 2 % et 5 % par mois (à 20°C).
Temps d'auto-décharge des batteries au plomb en fonction de la température ambiante. Les batteries au plomb s'auto-décharge d'autant plus vite que la température ambiante est élevée. Le taux d'auto-décharge des batteries actuelles, en terme de perte de capacité, est réduit en moyenne entre 2 % et 5 % par mois (à 20°C).
- La capacité de la batterie diminue. En effet, même lorsque la batterie alimente un récepteur électrique, les réactions secondaires se produisent.
L' électrolyse de l'eau :
L’électrolyse de l’eau est une réaction chimique forcée faisant intervenir les deux couples oxydants-réducteurs suivants :
La réaction d’oxydoréduction naturelle est décrite ci-après :
L’oxydant le plus fort est le dioxygène (O2). Celui-ci va se réduire eau (H2O) selon la demi-équation de réduction suivante :
De même, le réducteur le plus fort est le dihydrogène (H2). Celui-ci va s’oxyder en l’ion H+ selon la demi-équation d’oxydation suivante :
On obtient la réaction d'oxydo-réduction suivante :
Ainsi, en présence de dihydrogène et de dioxygène, ces deux éléments réagissent pour former de l’eau. Cette réaction chimique est naturelle.
La réaction inverse n’est pas naturellement possible. Si nous souhaitons décomposer l’eau en dioxygène et dihydrogène, il est nécessaire de forcer la réaction à l’aide d’un courant électrique. Pour cela, on utilise un générateur qui va forcer le passage des électrons dans le sens inverse. C'est ce qu'on appelle l'électrolyse de l'eau.
Notions de résistance interne pour une batterie
La résistance interne : ... qu'est-ce que c'est ?
La résistance interne correspond à la somme de la résistance électrique des matières solides (électrodes, connexions) et de la résistance électrolytique .
La résistance interne d’une batterie dépend :
- de sa capacité (plus le nombre et la surface des plaques augmentent, plus la surface d’échange augmente => plus la résistance interne diminue),
- de l’état de charge (lors de la décharge, du sulfate de plomb se forme sur les plaques => la résistance interne augmente),
- de la température (la baisse de la température augmente la viscosité de l’électrolyte => la résistance interne augmente),
- de la densité d’électrolyte (voir ci-dessous) .
Typiquement, la résistance interne des batteries est comprise entre 5 mΩ et 50 mΩ (0,005 et 0,050 ohm) . Les fabricants de batterie cherchent cependant à obtenir une résistance interne la plus faible possible .
La concentration d'acide sulfurique au sein de l’électrolyte joue un rôle important sur la résistance interne . Le graphe ci-dessous indique la résistivité de l’électrolyte en fonction de la concentration d’acide sulfurique :

Aux regards des courbes ci-dessus, nous constatons que :
- Plus la température augmente, plus la résistance interne de la batterie diminue .
- Pour une concentration d'acide sulfurique comprise entre 25% et 40 %, la résistance interne de l'électrolyte est minimale . Ainsi, les fabricants de batteries remplissent les batteries avec un électrolyte dont la concentration en acide sulfurique est sensiblement dans cette plage .
La résistance interne d'une batterie est donc définie comme l'opposition à la circulation du courant dans une batterie . Il y a deux composantes essentielles pour cette résistance : la résistance électronique et la résistance ionique .
Leur effet combiné est dénommée la résistance effective totale .
La résistance électronique englobe la résistivité des matériaux utilisés tels que le métal de couverture et les composants internes . Elle dépend aussi de la façon dont les matériaux sont en contact les uns avec les autres . L'effet de cette résistance est très rapide et peut être détecté dans les millisecondes premières après qu'une batterie est placée sous charge .
La résistance ionique est l'opposition au passage du courant dans la batterie due à des facteurs électrochimique divers tels que la conductivité de l'électrolyte, la mobilité des ions et la surface de l'électrode . Cet effet se produit plus lentement que la résistance électronique .
Un certain nombre de techniques sont disponibles pour mesurer la résistance interne de la batterie comme la méthode DC (courant continu) ou la méthode AC (courant alternatif) . Pendant la réalisation du test AC, il peut être remarqué que la résistance interne d'une batterie dépend de la fréquence, qui entraine une expression complexe de la résistance de la batterie ou plus précisément de son impédance . Cette dernière peut être présentée à l'aide d'une représentation de type Nyquist (partie imaginaire vs partie réelle) . Une forme générale d'une représentation de Nyquist de l'impédance électrochimique complexe d'une batterie plomb-acide à haute capacité est donnée par la figure 1.3 [8]
Fonctionnement des batteries au plomb
Rappel :
Un élément d'accumulateur au plomb est composé de deux électrodes, une plaque de dioxyde de plomb appelé anode (ou cathode) et une plaque de plomb appelé cathode (ou anode), et d'un séparateur micro poreux, l'ensemble baignant dans une solution d'acide sulfurique .
Par réaction chimique, une différence de potentiel d'environ 2 volts apparaît aux bornes de ce générateur élémentaire : un accumulateur de 2 volts est l'unité de base d'une batterie au plomb .
En reliant une charge entre ses deux bornes, un courant électrique s'établit circulant de l'anode vers la cathode .
Un élément d'accumulateur est un générateur réversible : en charge, l'électrode positive est l'anode et l'électrode négative est la cathode et en décharge, l'électrode positive devient cathode alors que l'électrode négative devient l'anode .
(voir chapitre Historique et théorie ) .
Principe de fonctionnement d'une batterie :
De tension nominale d'environ 2 Volts, un accumulateur au plomb est rarement utilisé seul mais est constitué de plusieurs générateurs élémentaires, regroupés en série et/ou en parallèle pour obtenir la tension de 12 volts .
Le regroupement permet aussi d'en augmenter la capacité d'utilisation désirée : plus vous ajouter de générateurs élémentaires plus vous augmenterez le courant débité et donc la capacité de l'accumulateur .
L'ensemble ainsi constitué est appelé " batterie d'accumulateurs " .
Une batterie de cellule ou de démarrage de "12V" comprend donc six accumulateurs, même si sa tension apparente aux bornes de celles-ci se situe entre 12,6V et 13,4V .
Pendant le cycle de décharge, le dioxyde de plomb de la cathode se transforme par oxydation en sulfate de plomb (PbSO4) en libérant de l'oxygène (02) et en captant des électrons (-0.365V). L'anode fixe la partie sulfurée de l'acide par réduction pour donner du sulfate de plomb (PbSO4) et libérer des électrons (1.685 V). Cette migration d'électrons crée un courant issu de l'électrode positive qui va traverser tous les récepteurs électriques branchés dans le véhicule pour revenir à l'électrode négative. A l'issue de la réaction chimique (batterie déchargée, l'électrolyte est constitué d'eau pure et les électrodes sont revêtues de sulfate de plomb (PbSO4); plus aucun ion n'est disponible pour réagir avec les électrodes, aucun courant ne peut plus être formé : la batterie est déchargée.
Pendant le cycle de charge, le processus est inversé et les électrodes retournent progressivement à leur état d'origine en s'accompagnant de formation d'hydrogène . La charge de la batterie est assurée par un générateur de tension continue, l'alternateur . Ce dernier produit une tension constante de l'ordre de 14 V.
Constitution d'une batterie :
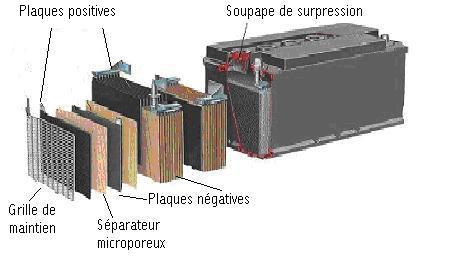
Photo 01 : coupe d'une batterie, quelqu'en soit la marque ...
Une batterie au plomb est constituée d'un certain nombre d'éléments accumulateurs montés en série et reliés par des connexions en plomb soudé (une batterie de 12 V contient 6 éléments) .
Les accumulateurs sont logés dans un bac en plastique (polypropylène, ABS...), fermé par un couvercle scellé .
Chaque accumulateur est composé d'un ensemble de couples d'électrodes positives et négatives . Ces plaques sont isolées par un séparateur micro-poreux, destiné à éviter les courts-circuits tout en laissant circuler les ions (charges électriques) .
Les électrodes sont formées d'une grille en alliage de plomb, dont les alvéoles sont remplies d'une pâte poreuse :
- de peroxyde de plomb PbO2 pour l'électrode positive,
- de plomb métallique Pb pour l'électrode négative .
Les électrodes baignent dans un électrolyte, solution diluée d'acide sulfurique H2SO4, sous forme liquide, sous forme de gel ou absorbée dans des feutres en fibre de verre .
Conception des électrodes :
Les électrodes ou plaques, de l’accumulateur au plomb, peuvent être planes ou tubulaires . Les plaques planes comportent une grille en alliage de plomb dont les fenêtres sont garnies, par « empâtage », de matériau actif . La grille assure un rôle de collecteur électronique mais aussi de support mécanique de la matière active .
Les électrodes tubulaires se composent d’une série de tubes juxtaposés . Chaque tube comporte axialement une tige en alliage de plomb, dite « épine » . Les épines, verticales, sont reliées entre elles par une barre horizontale située à la partie supérieure de l’électrode . Elles assurent ainsi la collecte du courant . La tenue mécanique de la matière active est assurée par des enveloppes poreuses, tissées ou non-tissées, enserrant chaque tube de matière active .
Les plaques négatives sont de géométrie plane, tandis que les grilles positives peuvent être de géométrie plane ou tubulaire.
Une batterie plomb-acide est constituée d’une alternance de plaques positives et de plaques négatives, comportant des séparateurs intercalés . Cet ensemble constitue un « faisceau » . ???????????
Composition des collecteurs :
Les grilles et les épines sont constituées d’alliages de plomb . Les éléments ajoutés au plomb sont destinés à modifier les performances mécaniques et électrochimiques et faciliter la fabrication des grilles . On rencontre deux grandes familles d’alliage : les alliages plomb-antimoine (PbSb) et les alliages plomb-calcium (PbCa) .
En Europe, Emile Alphonse Fauré a fabriqué une pâte de plomb composée d'oxyde de plomb, d'acide sulfurique et d'eau, qu'il a appliqué sur des plaques en plomb. Après avoir été séchées, celles-ci furent couvertes de sulfate de plomb. Une seule charge donnait à la plaque Fauré une capacité bien plus élevée qu'à la plaque Planté.
Malheureusement, l'adhésion de la masse active sur la surface lisse de la plaque ne durait guère et, après quelques cycles seulement, la batterie devint inutilisable. La solution vint en même temps de deux côtés : John Scudamore Sellon et Ernest Volckmar ont, tous les deux, fabriqué la plaque à grille enduite de pâte, telle qu'elle est encore utilisée aujourd'hui dans toutes les batteries à plaques plates.
Les nouvelles technologies et, plus particulièrement la construction de plaques, ont été protégées par un grand nombre de brevets complexes. C'est pour cette raison que de nombreux fabricants se sont mis à chercher un produit de remplacement pour l'oxyde de plomb comme matière de démarrage. Vers 1889, Clément Payen aux Etats-Unis et François Laurent Cely en Angleterre ont utilisé du chlorure de plomb. Après quelques années, leur procédé a été abandonné, mais ils ont cependant réussi à monter les deux plus grandes entreprises de fabrication de batteries au monde : la Electrical Storage Battery Company aux Etats-Unis et la Chloride Electrical Storage Syndicate, mieux connu sous le nom de Chloride Group, en Angleterre.
Les plaques tubulaires :
Dans le livre référence "Electrical World" de 1890, tome 16, un certain Monsieur S. Currie est enregistré pour avoir imaginé une plaque positive tubulaire. La force de la plaque provient de tubes, remplis de masse active, dans laquelle une spine de plomb sert de conducteur.
Dans ce concept, la force mécanique et la conductivité électrique sont deux choses séparées, à l'inverse de la plaque sous forme de grille, qui doit faire les deux : servir de support à la masse active et conduire l'électricité jusqu'aux bornes. Une plaque positive tubulaire est composée d'un certain nombre de spines, connectées entre elles par une barre à l'extrémité, comme une fourchette.
Les batteries tubulaires sont très populaires en Europe et au Japon, à cause de leur excellente performance en utilisation stationnaire et en traction. En anglais, on les appelle les Ironclad batteries et en allemand les Panzerplatten (abréviation : Pz). Les plaques tubulaires peuvent avoir 19 spines (DIN) ou 14 spines (standard britannique).
Alliage Plomb-Antimoine (PbSb) :
L’antimoine a été l’élément d’ajout le plus utilisé dans le passé . En effet, les alliages PbSb avaient auparavant été étudiés et utilisés dans le cadre de la fabrication des lettres d’imprimerie .
Leurs qualités métallurgiques étaient reconnues :
· température de fusion inférieure à celle du plomb pur,
· augmentation de la dureté du matériau,
· coulabilité aisée .
Initialement, proche de celle de l’eutectique (13% Sb) la composition des alliages Plomb-Antimoine a évolué dans le sens d’une réduction du taux d’antimoine .
Cette tendance trouve son origine dans le constat que l’antimoine libéré dans l’électrolyte par corrosion des collecteurs positifs, migre jusqu’à l’interface réactionnelle des électrodes négatives, s’y dépose, et réduit alors la surtension hydrogène . Il en résulte une dégradation du rendement faradique de charge des électrodes négatives qui peut aller jusqu’à une impossibilité pratique de recharge .
Les constructeurs ont cherché des substituts à l’antimoine : le calcium en est le principal représentant .
Alliage Plomb-Calcium (PbCa) :
La part de calcium allié au plomb est de l’ordre de 0,1 % . Cette faible teneur permet d’atteindre des qualités métallurgiques acceptables pour la fabrication des grilles . Les alliages plomb-calcium destinés à des applications mettant en jeu des décharges régulières contiennent également de l’étain, à des teneurs de l’ordre de 1% . En l’absence d’étain, en effet, les alliages de PbCa sont le siège de phénomènes de passivation de l’interface collecteur/matière active positive menant à des défaillances prématurées, par exemple après 200 cycles charge/décharge .
Principales catégories de batteries :
Il existe 3 principales catégories définies par leur domaine d'application :
- batterie de démarrage : utilisée dans les automobiles, elle est composée de plaques fines, de grande surface, et autorise des courants de décharge élevés, mais de courte durée,
- batterie de traction : utilisée dans les chariots élévateurs, elle est formée de plaques plus épaisses et permet des décharges journalières pouvant atteindre 80% de la capacité,
- batterie stationnaire : utilisée dans les ASI (alimentations sans interruption), conçue pour fonctionner en "floating" .
Le floating consiste à appliquer une tension proche de la tension de repos de la batterie, de façon à éviter l'auto-décharge. Il permet aussi d'alimenter les différents consommateurs d'énergie, en conservant la batterie chargée .
Les différentes technologies :
- conventionnelle : c'est une batterie ouverte, qui nécessite un apport régulier d'eau. Cette batterie est vendue "sèche", l'électrolyte est ajouté avant la première utilisation
-
VRLA (Valve Regulated Lead Acid) : c'est une batterie à soupape. En cas de dégazage, l'hydrogène et l'oxygène se recombinent à l'intérieur de la batterie pour former de l'eau. Si la pression interne devient trop forte, une vanne-soupape relâche les gaz : si ce stade est atteint fréquemment, l'électrolyte se déssèche et rend la batterie inutilisable
- type AGM (Absorbed Glass Mat) : une fine feuille de fibre, imbibée d’électrolyte (70% d’eau et 30 % d’acide) est placée entre les plaques de plomb de la batterie. Cette batterie peut fournir un courant élevé, de courte durée
- type GEL : l'électrolyte est figé par l'addition de gel de silice. Ces batteries sont étanches et peuvent être placées dans n’importe quelle position
Une batterie de cellule ou de démarrage plomb/acide (technologie "plomb ouvert") comprend des plaques planes positives et négatives assemblées en alternance (Photo 01) . Le nombre de plaques pour chaque polarité et leur surface sont des paramètres qui définissent la capacité de l'élément . Par exemple, l'électrode positive est comporte ici 4 plaques en parallèle, reliées par un connecteur . Pour éviter les courts-circuits entre les plaques de polarité différente, un séparateur micro poreux isolant est placé entre ces plaques lors du montage .
Les plaques positives et négatives sont assemblées en faisceaux (6) et plongées dans une solution d'acide sulfurique et d'eau distillée. Chaque faisceau constitue ainsi un élément.
L'ensemble est contenu dans un bac (en polypropylène, PVC ou ABS) muni d'orifices en partie supérieure pour permettre le remplissage des éléments et les compléments en eau si nécessaire ainsi que pour l'évacuation des gaz produits (Figure 4). Les deux bornes en plomb raccordées aux faisceaux de plaques de chaque polarité, permettent le raccordement de la batterie au circuit extérieur.
La batterie que nous utilisons pour alimenter notre installation électrique de la cellule est constituée d’un empilement d’accumulateurs au plomb : voir l'article ??????????
Le rôle de l'accumulateur est très important car c'est cet élément qui fournira une tension d'environ 2,1V aux bornes de ses électrodes puis mis en série avec six autres accumulateurs dans votre batterie, donnera cette tension apparente de 12V : d'ailleurs le nom originel d'une batterie est "batterie d'accumulateurs" .
Ces accumulateurs sont composés de plaques de plomb formant le pôle négatif et d’oxyde de plomb pour le pôle positif, le tout baignant dans un bain d’acide sulfurique jouant le rôle d’électrolyte. Chaque accumulateur délivrant une tension de base de 2.1V et il en faut donc six pour assurer les 12V de fonctionnement .
C’est un processus chimique, l’oxydoréduction, qui génère le courant électrique continu jusqu’à ce que les plaques se trouvent à l’équilibre.
Le terme "accumulateur" est employé pour un élément rechargeable, le distinguant1 ainsi de la pile (élément non rechargeable). Un accumulateur est donc un générateur réversible : il peut stocker (accumuler) de l'énergie, en convertissant l'énergie électrique en forme chimique, puis la restituer à tout moment sur demande.
De tension nominale d'environ 2 Volts, un accumulateur au plomb est rarement utilisé seul : en général, une mise en série et/ou en parallèle est effectuée pour obtenir les tensions et capacités d'utilisation désirées, ce qui constitue une batterie d'accumulateurs2. Par exemple, la batterie de démarrage d'un véhicule thermique est annoncée de "12V" pour signifier qu'elle comprend six accumulateurs, même si sa f.e.m. réelle se situe plutôt dans l'intervalle {12,5 ; 13V}. Pour les systèmes de secours, un standard de batterie 48V tend à s'imposer.