Historique et théorie
Préambule :
Si le plomb a disparu dans le transport et la distribution de notre eau potable, il reste bien présent, pour des décennies, dans nos batteries d'accumulateurs au plomb .
Pour comprendre comment fonctionne votre batterie, il est important de savoir comment il a été possible de stocker de l'énergie électrique dans une boîte en plastique ! … alors que vous savez comment stocker (ou graver) des données sur un disque ou un support informatique .
Bref rappel historique :
Le premier accumulateur au plomb fut mis au point par le scientifique belge Monsieur Gaston Planté au XIXième siècle, en 1859 exactement : le 26 mars 1860, il présentera à l'Académie des Sciences, sa célèbre communication sur une "nouvelle pile secondaire d'une grande puissance" . (voir l'article sur Les découvertes )
On parlait déjà de " pile " car celle-ci fut découverte vers la fin du XVIIIième et c'est en 1800 que Monsieur Alessandro Volta en fit la première démonstration en réalisant un empilement d'éléments composés successivement d'une lame de zinc, d'une lame de feutre imbibée d'eau vinaigrée et d'une lame de cuivre . Il créa ainsi le premier dispositif de production électrochimique d'énergie électrique : la dénomination " pile " qui lui est attribuée trouve son origine dans la structure de ce " générateur " : un empilement de générateurs élémentaires .
Ensuite l'unité de tension (différence de potentiel) aux bornes de ces générateurs sera le Volt, en hommage à Alessandro Volta, à l'origine de la découverte de la pile voltaïque .
La grande découverte fut donc cette fameuse pile rechargeable ! … la différence entre une pile et un élément d'accumulateur est que la pile, une fois son énergie restituée, reste inutilisable alors que l'accumulateur aura la possibilité de régénérer ses plaques internes, de stocker de l'énergie et de fournir à nouveau un courant d'où la formulation de " pile secondaire d'une grande puissance " !
Le terme « accumulateur », employé pour un élément rechargeable, le distinguant ainsi de la pile (élément non rechargeable) est un générateur réversible : il peut stocker (accumuler) de l'énergie en convertissant l'énergie électrique en forme chimique, puis la restituer à tout moment sur demande en retransformant cette matière chimique en énergie électrique .
Ce processus serait quasiment " sans fin " s'il n'y avait pas la fatigue des éléments internes et leur détérioration .
Ce qui va suivre a été volontairement simplifié, pas de formules chimiques, pour que vous compreniez bien ce qui se passe à l'intérieur de votre bac quand vous branchez votre batterie 12 Volts sur votre installation ou/et quand vous rechargez celle-ci .
Cela vous aidera à mieux appréhender par la suite les divers symptômes rencontrés lors de l'existence de votre batterie d'accumulateurs tels que :
- élévation anormale de la température,
- déformation du bac,
- sulfatage des bornes,
- batterie ne tenant plus la charge,
- etc, etc ...
Fonctionnement d'un élément d'accumulateur :
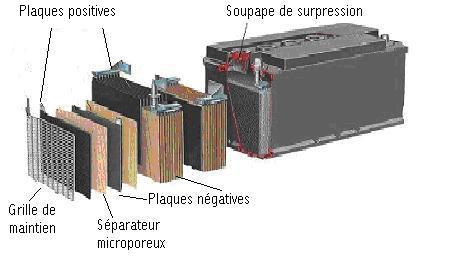
Un accumulateur au plomb élémentaire est constitué d'une plaque de plomb spongieux (Pb) et d'une plaque de bioxyde de plomb (PbO2) .
Quand ces plaques sont plongées dans une solution d'acide sulfurique (H2SO4), cet accumulateur est soumis à deux réactions chimiques différentes qui sont :
- la décharge lorsqu'un récepteur est raccordé sur ses bornes,
- la charge lorsqu'une tension externe est présente à ses bornes .
Explications :
a) Phénomène de décharge :
Quand deux électrodes, les deux plaques de plomb, sont plongées dans l'électrolyte (mélange d'eau distillée 65% et acide sulfurique 35%) et que l'on relie un récepteur aux bornes de l'accumulateur, entre le positif et le négatif, les réactions chimiques créent la circulation d'un courant électrique .
Ce courant électrique s'établit entre la plaque de bioxyde de plomb, appelée anode, et la plaque de plomb appelée cathode . ????????????????
Pendant cet état de décharge, le bioxyde de plomb de la plaque positive (anode) se transforme ????????????graduellement en sulfate de plomb (PbSO4) et le plomb spongieux de la plaque négative (cathode) se transforme ???????????également en sulfate de plomb .
Lorsque les plaques deviennent identiques, la même quantité de sulfate de plomb de part et d'autre, la différence de potentiel entre ces deux plaques s'annule et la circulation du courant s'interrompt : l'élément d'accumulateur est en situation de décharge profonde !
La quantité d'électricité circulant pendant une période de décharge déterminera la capacité de la batterie .(voir chapitre Les capacités)
En résumé, au cours de la décharge :
Anode (+) : - le bioxyde de plomb diminue, - le sulfate de plomb augmente,
Cathode (-) : - le plomb diminue, - le sulfate de plomb augmente,
Electrolyte : - le % d'eau augmente, = 85% - le % d'acide diminue, = 15%
b) Phénomène de charge :
Afin de recharger l'accumulateur, il faut relier les bornes de l'accumulateur à celles d'une source de tension continue (chargeur de batterie) : la borne de la source de tension à la borne de l'accumulateur (anode), celui-ci devenant récepteur vis-à-vis de la source de tension .
Le sens de circulation du courant électrique pendant la charge est l'inverse du sens de circulation de la situation de décharge .
Le sulfate de plomb présent sur les deux plaques est dissous par le passage du courant et les plaques reprennent leur état initial .
Le phénomène chimique serait "sans fin", s'il n'y avait pas la fatigue des éléments internes et leur détérioration .
En résumé, au cours de la charge :
Anode ( ) : - le bioxyde de plomb augmente, - le sulfate de plomb diminue,
Cathode (-) : - le plomb augmente, - le sulfate de plomb diminue,
Electrolyte : - le % d'eau diminue, - le % d'acide augmente .
Conclusions :
1 . Pendant la décharge de l'élément accumulateur (qui correspond à l'utilisation de votre batterie : éclairage, réfrigérateur, etc...) la réaction chimique forme des cristaux de sulfate de plomb insolubles qui cristallisent dans les pores des plaques de l'accumulateur .
Au niveau de l'électrolyte, la concentration d'acide diminue fortement : si vous mesurez la densité de l'électrolyte à l'aide d'un pèse-acide avant (sur une batterie chargée) et après (sur une batterie en décharge ou totalement déchargée), vous trouverez des valeurs très différentes .
2 . Pendant la charge de l'élément accumulateur (mise en charge par votre panneau solaire ou votre chargeur secteur) la réaction chimique se fait essentiellement autour de la reconstitution d'acide sulfurique autour des électrodes .
Conséquences :
Lors d'une charge après une décharge relativement profonde, une importante quantité d'acide sera reconstituée au niveau des plaques . Cet acide concentré se mettra à suinter vers le fond de votre batterie . Généralement, vers 90% de la phase de recharge, la partie basse des éléments contient de l'électrolyte concentré et la partie haute de la cuve, de l'électrolyte dilué : on dit que l'électrolyte est stratifié .
Arrêter la charge à ce stade aurait des conséquences désastreuses, à savoir un fonctionnement hétérogène des électrodes, menant à une fatigue rapide de leur partie inférieure, d'où l'importance de s'équiper d'un excellent régulateur de charge au niveau de votre panneau solaire et d'un chargeur de batterie de grande qualité voire de type IUoU .
Les 10 derniers % de recharge sont les plus importants, ceux sont eux qui vont conditionner la durée de vie de votre batterie .
La phase finale de la charge est dite « de surcharge » .
C'est la phase pendant laquelle le courant se partage en un courant de charge proprement dit et en un courant d'électrolyse .
L'électrolyse c'est quoi ? … ici on parle de l'électrolyse du liquide se trouvant dans la partie haute de la cuve : l'électrolyse de l'eau est un procédé qui décompose l'eau en créant de l'oxygène et de l'hydrogène lorsqu'elle est traversée par un courant électrique .
(voir chapitre Processus d'autodécharge )
Ce courant d'électrolyse produira de l'oxygène à l'électrode positive et de l'hydrogène à l'électrode négative . L'intérêt de ce processus étant de se rapprocher le plus possible de l'état de charge complète de l'accumulateur mais aussi, grâce au dégagement gazeux dans la cuve, de réhomogénéiser la concentration de l'électrolyte puisque l'électrolyte concentré se trouve en partie basse de la cuve .
Cette réhomogénéisation de l'électrolyte est la principale fonction à assurer en fin de charge . Elle est nécessaire à chaque charge, sous peine d'entraîner un fonctionnement hétérogène des électrodes menant à une réduction importante de leur durée de vie .
Si vous avez bien compris le processus de fonctionnement de cet élément d'accumulateur, vous saurez déceler par la suite les anomalies pouvant survenir sur votre batterie .
(voir chapitre suivant Le fonctionnement des batteries )
Inscrivez-vous au blog
Soyez prévenu par email des prochaines mises à jour
Rejoignez les 2 autres membres